ホルマリン固定組織をがん抗原として使えるのか?
これは、医師の先生方から聞かれる最も多い質問の一つです。
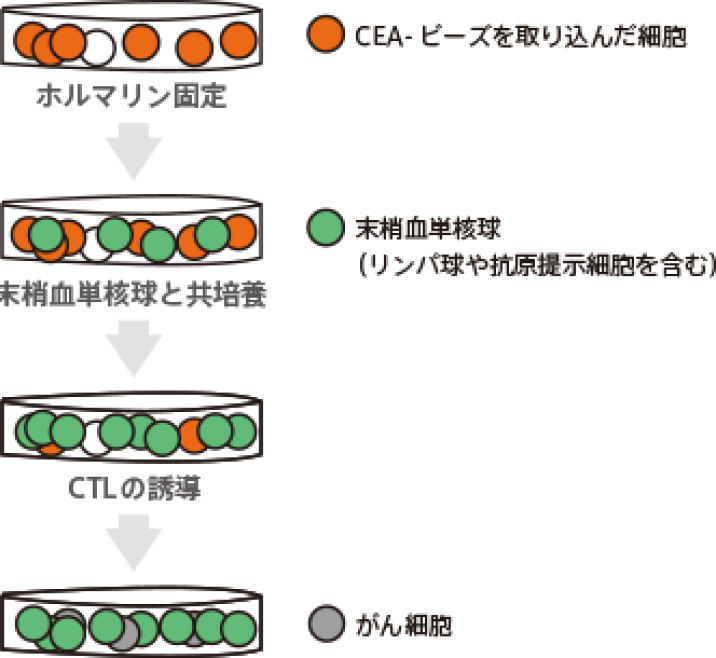
自家がんワクチンの開発は、このホルマリン固定細胞上で、がん特異的なCTLの誘導培養に成功したところから始まります。
まず、既知のがん抗原であるCEAタンパクをビーズを使って細胞内に取り込ませます。その後にホルマリンで固定し、CTLを誘導する際の抗原として使用します。そして、誘導されたCTLがきちんとCEA中のがん抗原ペプチドを認識するのかを確認しました。
※ホルマリンは、自家がんワクチンの製造工程で十分に洗浄除去されています。安全性には全く問題ないレベルとなっています。
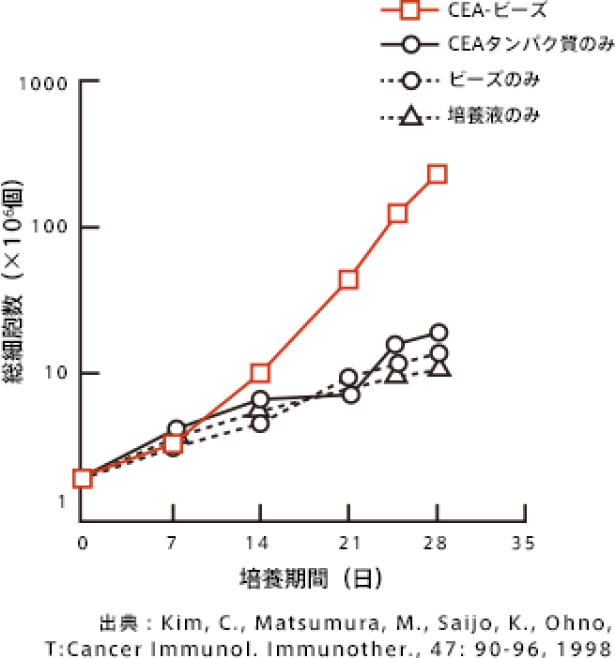
CEA-ビーズを食べさせホルマリン固定した細胞上でもCEAに対する自家CTLは誘導できる
下図からCEAを食べさせたホルマリン固定細胞を使うと、他の対照群の固定細胞と比べて、リンパ球が良く増殖しているのがわかります。
では、これらのリンパ球はがんを殺すことができるのでしょうか?
CEA-CTLはCEA産生がん細胞だけを殺す
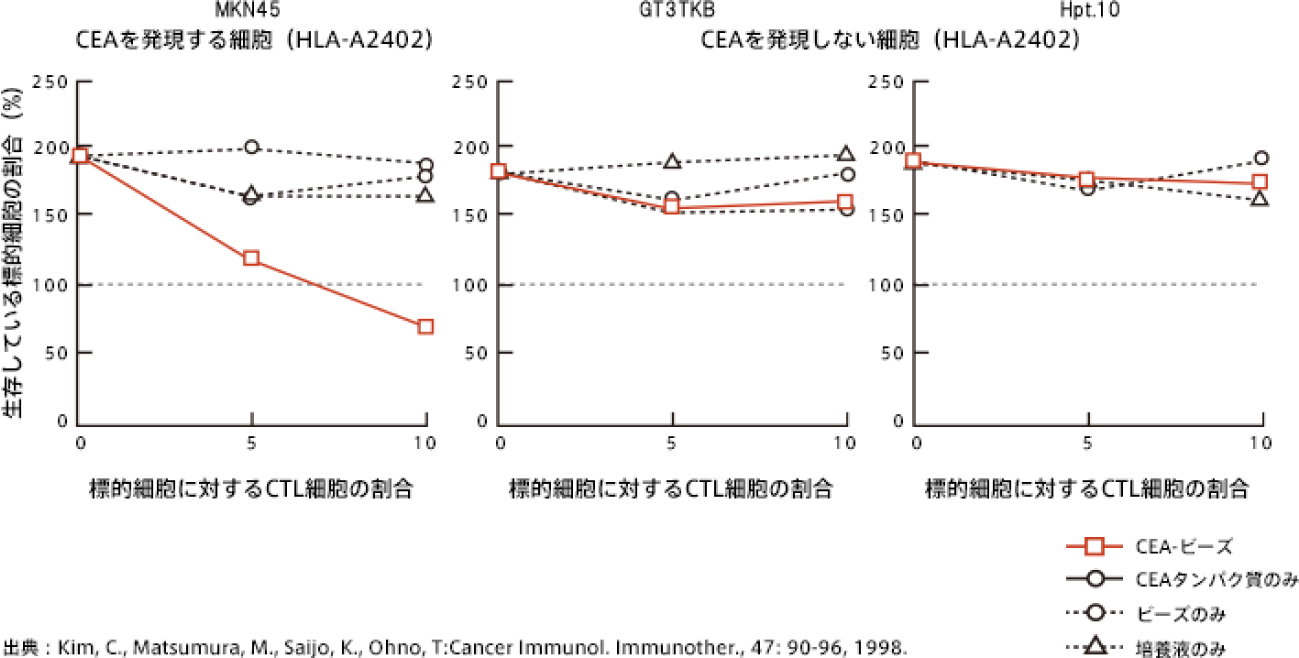
先ほどの実験で、ホルマリン固定細胞上でもリンパ球を増やすことが可能なことがわかりましたが、大切なのは、これらのリンパ球がCEA特異的にがん細胞を殺すかどうかというところです。
そのため、CEAを発現しているがん細胞とCEAを発現していないがん細胞を使って、これらを殺す能力があるかどうかを試してみました。すると、下図のように、CEAを発現しているがん細胞(MKN45)だけを殺すことがわかりました。
増殖したリンパ球はMKN45を一定の割合で殺すことができるため、がん細胞に対して加えるリンパ球の割合を増やすと、よりがん細胞が殺されるようになるのがわかります。
一方、CEAを発現していないがん細胞のGT3TKBやHpt.10は、いくらリンパ球を加えても殺されることはありません。
ここから、CEAビーズを食べさせた細胞をホルマリン固定処理した後からでも、CEA特異的なリンパ球(CTL)の誘導が可能であることがわかります。つまり、ホルマリン固定後のがん細胞も十分な抗原性を維持しているのです。
自分のがん組織を使う意味
主役のがん抗原だけでなく、脇役のがん抗原にも抗腫瘍活性がある
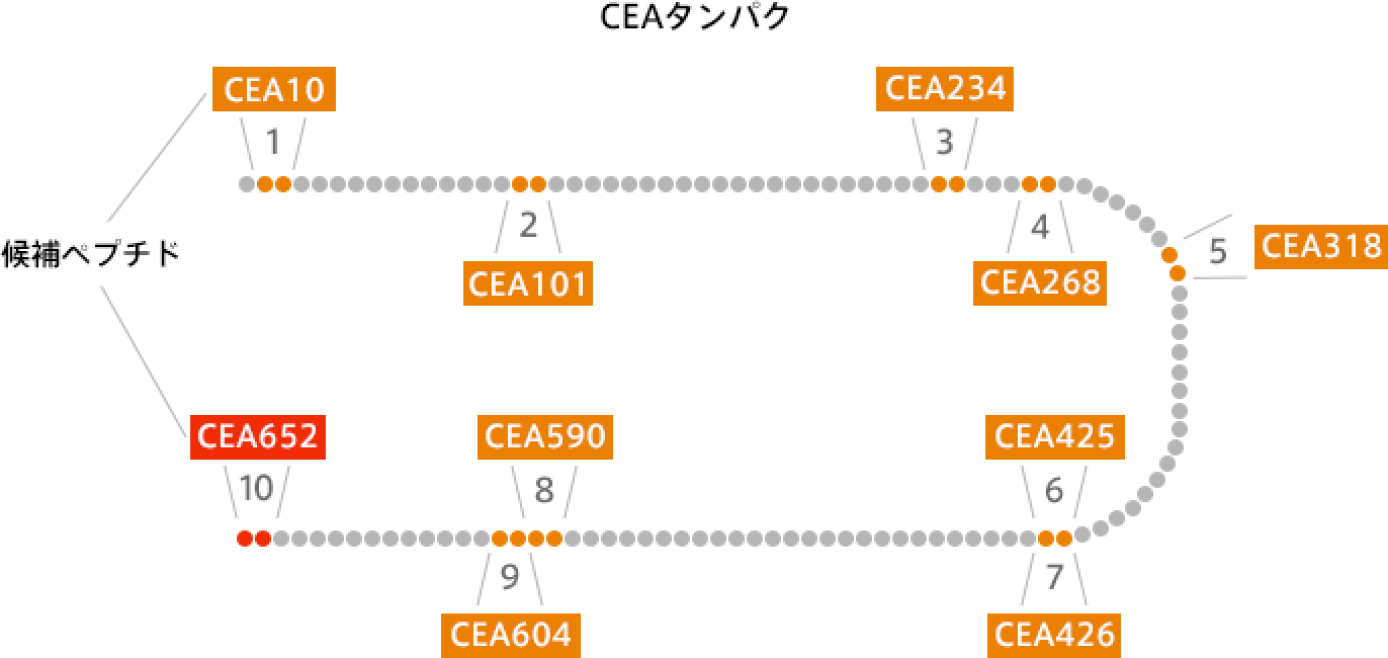
先ほどまでの実験で、ホルマリン固定したがん細胞にも、がん抗原が残っていることを確かめてきましたが、我々は更に面白いことを発見しました。それは、がん抗原として認識される場所の数です。
通常、がん抗原は、抗原提示細胞に取り込まれた後、ペプチドと言われる9-10個のアミノ酸に分解され、このペプチドを目印として、リンパ球にがん細胞の特徴を教えます。このペプチドの中にも目印として使いやすいところと、そうでないところがあるのです。
CEAの中でも、図の赤い部分は目印となりやすいことが分かっています。しかし、それ以外の部分もがん抗原として活用することができます。
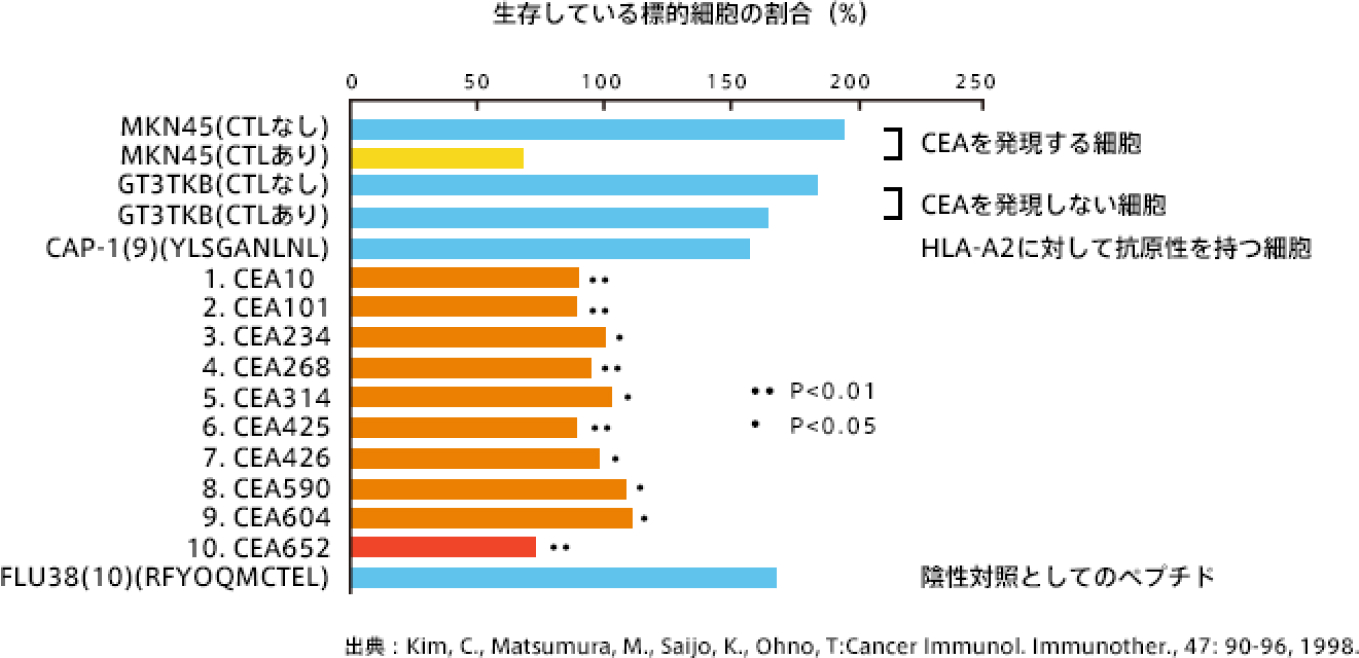
実際にCEAタンパク中の候補ペプチドを使って、抗腫瘍活性を調べてみると、確かに赤い部分を認識するCTLは強い抗腫瘍活性がありますが、他のオレンジの部分も赤い部分に比べると弱いものの、コントロールと比べると抗腫瘍効果があるのがわかります。
つまり、ホルマリン固定されたCEAタンパクからも実は多数のがん抗原ペプチドが壊れないで発生していること、それらを認識する多種類のCTLクローンが、この誘導されたCEA-CTLには含まれていることを示しています。
言い換えれば、もともとのCEAタンパク由来の多数のがん抗原ペプチドはホルマリン固定処理されても壊れないで抗原として機能したため、多種類の CTLクローンが誘導されたことがわかります。
がん抗原CEAタンパク一種類からでさえ、これほど多種類のがん抗原ペプチドが発生するなら、もしその他にもがん抗原タンパクががん細胞に含まれていれば、それらから発生するがん抗原ペプチドは膨大な種類になると思われます。
従来のペプチドワクチンのように、合成したわずかな種類のがん抗原ペプチドで全体のがん抗原を代替させようとしても、とても無理なのがご理解いただけると思います。
この点にこそ、がん患者様自身のホルマリン固定がん組織そのものを丸ごとそのままがんワクチンのがん抗原としてしまうため、その患者様本人特有の膨大な種類のがん抗原を極力もらすことなく有効利用できる「自家がんワクチン」の優位性があります。